2.7. Роль обменного взаимодействия в образовании кристаллов
Из рассмотренного выше следует более глубокое понимание вопроса о природе сил связи в твердых телах. Дело в том, что область проявления направленной ковалентной связи не ограничивается только атомными кристаллами, а распространяется на ионные и металлические кристаллы. Оказывается, что все ионные кристаллы имеют определенную долю ковалентности, значительна эта доля и в металлических кристаллах. Даже в таких типичных ионных кристаллах, как хлористый натрий, нельзя объяснить деталей его кристаллического строения, исходя лишь из действия между ионами центральных ненаправленных кулоновских сил. Структура этого кристалла указывает на то, что силы связи должны быть направлены вдоль ребер элементарного куба, и эти силы приводят к построению ионов хлора и натрия в простую кубическую структуру. Возникновение таких направленных сил объясняется проявлением обменного взаимодействия при перекрывании электронных облаков ионов хлора и натрия.
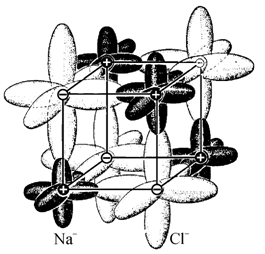
Ионы хлора имеют полностью застроенную внешнюю оболочку, включающую в себя два s-электрона и шесть p-электронов. Согласно изложенным в предыдущем разделе представлениям об атомных орбиталях, электронная плотность распределена для s-электронов в виде шарового слоя небольшого радиуса, а три пары p-электронов образуют секстет вытянутых по осям координат орбиталей, обладающих ортогональной симметрией. Продольный размер этих орбиталей значительно превышает диаметр шарового слоя s-электронов. Поэтому в образовании кристаллической структуры хлористого натрия основную роль приобретает взаимодействие именно p-электронов. Под действием сил Кулона разноименно заряженные ионы натрия и хлора сближаются до таких расстояний, что их внешние электронные орбитали входят в соприкосновение своими вытянутыми кольцами и частично перекрываются (рис. 2.23). Такое перекрытие, связанное с обменным взаимодействием, вследствие ортогональности p-орбиталей должно приводить и приводит к структуре элементарного куба (с учетом ионных радиусов натрия и хлора).
Таким образом, центральные ненаправленные силы электростатического притяжения лишь сближают разноименные по заряду ионы, образование же кристаллической решетки с правильным расположением ионов происходит благодаря обменному взаимодействию ортогонально расположенных p-орбиталей. Для кристаллической решетки NaCl направление сил обменного взаимодействия совпадает с направлением максимальных сил кулоновского притяжения − вдоль ребер куба.
|
|
|
Рис. 2.23. Конфигурация электронных орбиталей в структуре NaCl [55] |
В другом случае, например хлористого цезия, соотношение ионных радиусов хлора и цезия таково, что позволяет этому кристаллу приобрести структуру объемноцентрированного куба. В этом случае перекрываются ортогональные p-орбитали одноименных ионов. Здесь силы обменного взаимодействия направлены вдоль ребер куба, как и для NaCl, но максимальные силы кулоновского взаимодействия направлены иначе − по пространственным диагоналям куба.
Для металлических кристаллов, как уже было сказано выше, представление о силах связи строится на том, что она осуществляется взаимодействием коллективизированных электронов и положительных ионных остатков. Однако такое представление нельзя считать исчерпывающим. Ненаправленное взаимодействие валентных электронов с ионами в металлах должно приводить к плотным кристаллическим упаковкам с координационным числом, равным 12, если предполагать, что ионы металлов обладают сферической симметрией внешних электронных оболочек. В некоторых случаях так оно и есть. Но многие металлы имеют структуру объемноцентрированного куба с координационным числом, равным 8. Это говорит о том, что в структуре таких металлов присутствуют направленные связи, что требует представления о несферической симметрии ионов. Силы связи в металлах не могут возникнуть за счет обменного взаимодействия валентных электронов вследствие их малого количества. Кроме того, занятие валентных электронов в направленных ковалентных связях противоречит самой идее о свободных электронах, согласно которой электроны не рассматриваются локализованными в определенных направлениях. Выход заключается в том, чтобы считать валентные электроны почти свободными, т. е. полностью сохранить модель коллективизированных электронов, а происхождение кристаллической структуры металлов искать во взаимодействии внешних оболочек металлических ионов.
Рассмотрим
этот вопрос на примере химической связи в кристалле натрия. Он имеет структуру
объемноцентрированного куба (ОЦК) и в кристаллической решетке однократно
ионизирован. Главная компонента энергии кристаллической решетки металлического
натрия обусловлена связывающим действием свободных электронов. Однако тот факт,
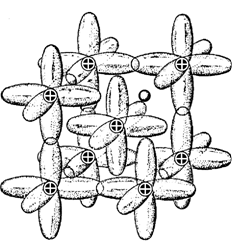
что натрий имеет неплотную ОЦК структуру с координационным числом ![]() , указывает на дополнительное направленное взаимодействие
ионов. Сближение ионов в результате взаимодействия с электронным газом приводит
к перекрытию ортогональных p-орбиталей, что ведет к
появлению обменных связей, направленных по ребрам куба и «ответственных» за
возникновение ОЦК структуры (рис. 2.24).
, указывает на дополнительное направленное взаимодействие
ионов. Сближение ионов в результате взаимодействия с электронным газом приводит
к перекрытию ортогональных p-орбиталей, что ведет к
появлению обменных связей, направленных по ребрам куба и «ответственных» за
возникновение ОЦК структуры (рис. 2.24).
|
|
|
Рис. 2.24. Конфигурация электронных орбиталей в структуре Na [55] |
Таким образом, кулоновское взаимодействие ионов в ионных кристаллах и металлическая компонента связи в металлах являются изначальной причиной, сближающей ионы до расстояний, обеспечивающих перекрытие электронных оболочек, а возникающие при этом силы обменного взаимодействия выполняют весьма существенную упорядочивающую функцию, обеспечивающую формирование конкретной кристаллической структуры.