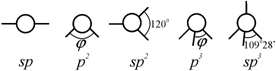2.6. Случай направленного взаимодействия. Структура веществ с ковалентными связями
Ковалентная связь существенно отличается от металлической и ионной тем, что обладает направленностью и, как следствие этого, насыщенностью. Структуры, образованные ковалентно связанными атомами, имеют координационные числа, равные валентности атома. Это условие является следствием минимума потенциальной энергии. При ковалентных связях энергетически выгодно становится использовать небольшое число имеющихся связей, т. к. попытка присоединения дополнительных атомов ведет к повышению потенциальной энергии вследствие отталкивания атомов. Это и есть условие насыщенности. Ковалентная химическая связь очень прочна, о чем можно судить на примере типично ковалентного кристалла алмаза (рис. 1.23), обладающего наибольшей твердостью среди всех твердых тел. Конфигурации, образуемые ковалентно связанными атомами, при значениях валентности 1, 2, 3, 4 удовлетворяют принципу «рыхлой» упаковки атомов и определяются числом, прочностью и симметрией распределения валентных электронов, характеризуемой валентными углами между связями ji. Виды последней для s- и p-валентных электронов показаны на рис. 2.19 [55].
|
|
|
Рис. 2.19. Конфигурации ковалентных связей, образуемых s- и p-валентными электронами |
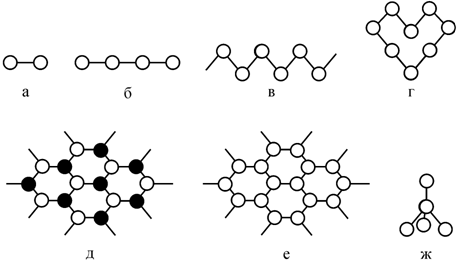
Рассмотрим особенности структур, образованных ковалентными связями между одинаковыми атомами. Одновалентные атомы образуют только двухатомные молекулы (рис. 2.20, а). Для двухвалентных атомов имеется несколько возможностей, а именно: образование бесконечных линейных (рис. 2.20, б) или зигзагообразных (рис. 2.20, в) цепочек. Цепочки могут замыкаться в кольцевые молекулы (рис. 2.20, г), как это имеет место, например, для ромбической серы (рис. 2.15, б). Полупроводниковые модификации селена и теллура построены из длинных зигзагообразных цепочек (рис. 2.15, а), свернутых в спирали. Для трехвалентных атомов возможны две симметричные конфигурации: пирамидальная (j <120o) и плоская (j =120o) (рис. 2.19). В первом случае реализуется структура, представляющая собой слои, построенные из параллельных плоских сеток с тройными осями симметрии (рис. 2.20, д, черными и светлыми кружками показаны атомы, находящиеся в разных слоях).
|
|
|
Рис. 2.20. Типы структур, образуемых атомами различной валентности |
Расстояния между сетками зависят от валентных углов между связями j. Такую структуру имеют, например, ромбоэдрические кристаллы мышьяка, сурьмы и висмута. Из плоских тройных связей между атомами образуется «графитовая» сетка, состоящая из правильных шестиугольников (рис. 2.20, е). Такая структура может получиться спрессовыванием в плоскость двойной «висмутовой» сетки. Если в узлах такой решетки находятся атомы углерода, то вещество называется графит. Расстояние между атомами в плоскости (1,43 Å) много меньше расстояния между слоями (3,35 Å), что объясняет такое свойство графита, как легкое скольжение одного слоя по отношению к другому. Между атомами в каждом слое существуют прочные и направленные ковалентные связи, поэтому графит прочен по слоям. Между слоями действуют слабые вандерваальсовы силы связи, поэтому кристалл графита легко разрушить вдоль атомных слоев даже при легком нажиме. Расположение атомов углерода шестиугольниками в плоскостях, параллельных основанию гексагональной призмы, у графита является характерным признаком целой группы органических соединений, называемых «ароматическими».
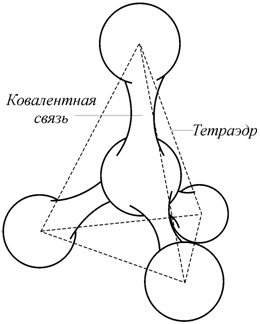
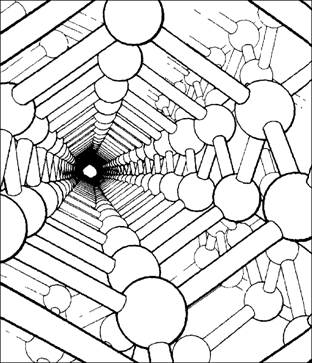
Основным видом связи в полупроводниковых кристаллах является ковалентная связь (рис. 2.21). Координационный многогранник в виде тетраэдра, реализуемый в некоторых полупроводниках, показан на рис. 2.21, а на рис. 2.22 [103] проиллюстрирован вид структуры алмаза, атомы углерода в котором удерживаются в кристаллической решетке ковалентной связью.
|
|
|
Рис. 2.21. Тетраэдрическая связь в полупроводниках [103] |
|
|
|
Рис. 2.22. Приблизительный вид структуры алмаза вдоль направления [110] |