13.3. Фазовые переходы в
твердом состоянии
Рассмотрим более подробно фазовые переходы I рода в твердом состоянии. Здесь становится очевидной необходимость изменения кристаллической структуры материалов, претерпевающих фазовое превращение. Однако следует помнить, что в твердом состоянии перестройка структуры имеет место и в результате процессов, не являющихся фазовыми переходами. Это, например, происходит при рекристаллизации, пластической деформации скольжением и двойникованием. Такие процессы отличаются от фазовых превращений причиной изменения кристаллической решетки: атомы занимают новые положения под действием поверхностных или упругих сил, внешнего натяжения, а не вследствие того, что термодинамический потенциал одной кристаллической конфигурации ниже (или выше), чем другой [10].
Согласно изложенным выше принципам, фазовый переход первого рода низкотемпературной кристаллической модификации в высокотемпературную должен сопровождаться увеличением объема V и энтропии S. Из этого вытекает ряд следствий, относящихся к структуре образующейся фазы:
• высокотемпературные фазы характеризуются более рыхлой структурой, в которой атомы имеют более низкие координационные числа;
• высокотемпературные фазы более разупорядочены;
• структура высокотемпературных фаз относится к более высокому классу симметрии, нежели низкотемпературных.
Аналогичный набор правил сформулирован и для фаз, возникающих в результате фазовых превращений при высоких давлениях. Переход I рода из фазы низкого давления в фазу высокого давления должен сопровождаться понижением объема V. Это следует из равенств
|
|
(13.23) |
Компенсация уменьшения объема должна происходить за счет увеличения внутренней энергии системы и (или) уменьшения энтропии. Это ведет к тому, что:
• фазы высокого давления должны обладать более плотной структурой, чем фазы низкого давления, следовательно, их координационные числа должны быть выше;
• фазы высокого давления более упорядочены.
Видно, что рост температуры и снижение давления ведут к одинаковым следствиям. Например, для бинарного соединения типа AB возможные изменения структуры при фазовых переходах I рода в твердом состоянии можно проиллюстрировать следующей схемой:
|
Структура типа CsСl |
увеличение Т ® увеличение р ¬ |
Структура типа NaСl |
увеличение Т ® увеличение р ¬ |
Структура типа ZnS |
где ![]() −
координационное число, а −
период кристаллической решетки, который представлен для типа структуры, формула
которой расположена на схеме выше.
−
координационное число, а −
период кристаллической решетки, который представлен для типа структуры, формула
которой расположена на схеме выше.
Типы переходов в твердом
состоянии
Все переходы в твердом состоянии делятся: на реконструктивные, деформационные, переходы типа «порядок – беспорядок», переходы с изменением химических связей [10].
1. Реконструктивные переходы сопровождаются перестройкой системы, которая происходит с разрывом большого количества межатомных связей и установлением новых связей. Такие переходы имеют высокую энергию активации и протекают медленно, поэтому другое их название – «медленные переходы». Реконструктивный (медленный) фазовый переход может не состояться из-за кинетических затруднений (малые скорости), хотя с термодинамической точки зрения такие переходы выгодны. Симметрии и пространственные группы кристаллов по разные стороны от точки такого перехода резко отличаются друг от друга.
2. Деформационные переходы происходят без разрыва химической связи, а путем ее искажения. При таких переходах имеет место лишь небольшое изменение кристаллической решетки. Энергия активации таких переходов мала, поэтому переходы происходят быстро − «быстрые переходы».
Реконструктивные
и деформационные переходы могут затрагивать
I и II координационные сферы. В
случае первых, например, алмаз с первым координационным числом ![]() может переходить в
графит с
может переходить в
графит с ![]() , в результате чего происходит полное разрушение кристаллической
решетки исходной фазы. Кристаллическая структура типа хлорида натрия NaCl, первое координационное
число в которой
, в результате чего происходит полное разрушение кристаллической
решетки исходной фазы. Кристаллическая структура типа хлорида натрия NaCl, первое координационное
число в которой![]() , может обратимо переходить в структуру типа хлорида цезия CsCl с координационным числом
, может обратимо переходить в структуру типа хлорида цезия CsCl с координационным числом ![]() .
.
В качестве деформационного перехода, затрагивающего первую координационную сферу, можно привести пример превращения a-кварца в b-кварц (α-SiO2 « β-SiO2).
Реконструктивный переход β-тридимит → β-кристобалит затрагивает II координационную сферу. Полный процесс фазового перехода для SiO2 можно проиллюстрировать следующей схемой с указанием температурных пределов устойчивости каждой их структур: α-кварц 575˚С β-кварц 870˚С « β-тридимит 1470˚С « β-кристобалит 1710˚С « расплав.
3. Переходы типа «порядок – беспорядок» подразделяются на следующие виды:
• типа замещения (медленные), например переход низкотемпературной модификации LiFeO2 в высокотемпературную;
• ориентационные (вращательные, быстрые), например переход соединения NH4H2PO4 из сегнетоэлектрического в параэлектрическое состояние. Здесь смещение атомов водорода приводит к изменению ориентации тетраэдров в цепочке O-H-O. В низкотемпературной фазе (сегнетоэлектрик) эти тетраэдры имеют одинаковую ориентацию. В параэлектрической фазе тетраэдры располагаются неупорядоченно.
4. Фазовый переход с изменением химической связи сопровождает переход белое олово – серое олово. Здесь связь меняется от ионной до металлической.
Сравним два состояния системы, состоящей из атомов сортов A и B, при одинаковой температуре: 1) неупорядоченный твердый раствор и 2) смесь кристаллов чистых компонентов. Любое состояние системы можно осуществить большим числом переходов. Из всех возможных состояний в статистической системе осуществляется наиболее вероятное. Равновесие системы достигается в максимуме вероятности. Энтропия связана с вероятностью формулой Больцмана
|
|
(13.24) |
где ω – вероятность нахождения термодинамической системы в данном состоянии.
Энтропия твердого
раствора больше энтропии смеси кристаллов, т. к. в первом случае имеется
большее число способов размещения атомов. Соответствующий избыток энтропии
называется энтропией смешения ![]() . Для вычисления
. Для вычисления ![]() представим, что все N узлов решетки кристалла свободны, и разместим атомы B в этих узлах. Для
размещения первого атома имеется N узлов, для размещения
второго – (
представим, что все N узлов решетки кристалла свободны, и разместим атомы B в этих узлах. Для
размещения первого атома имеется N узлов, для размещения
второго – (![]() ) узлов. Если бы атомы были различимы, то число возможных
размещений двух атомов по N узлам
равнялось бы
) узлов. Если бы атомы были различимы, то число возможных
размещений двух атомов по N узлам
равнялось бы ![]() . В случае неразличимых атомов это число сокращается в два
раза – число перестановок двух атомов по двум узлам, т. е. имеется
. В случае неразличимых атомов это число сокращается в два
раза – число перестановок двух атомов по двум узлам, т. е. имеется ![]() отличающихся друг от
друга размещений двух атомов. Добавление третьего атома приводит к увеличению
числа возможных размещений до
отличающихся друг от
друга размещений двух атомов. Добавление третьего атома приводит к увеличению
числа возможных размещений до ![]() . Для всех NB атомов число различных
комбинаций
. Для всех NB атомов число различных
комбинаций ![]() .
.
После того,
как атомы B размещены по узлам,
устанавливается окончательное распределение, поскольку все оставшиеся узлы
следует заполнить атомами A, т. е. полученное выше
выражение представляет собой статистическую вероятность ω, которая после умножения числителя и знаменателя на ![]() принимает вид
принимает вид
|
|
(13.25) |
В модели механической смеси кристаллов чистых компонентов существует только один вариант размещения атомов B в кристаллической решетке чистого компонента B и атомов A в кристалле A. Поэтому
|
|
(13.26) |
Статистическая вероятность в системе, состоящей из гетерогенной смеси кристаллов чистых компонентов, равна
|
|
(13.27) |
Из полученных выражений можно найти энтропию смешения
|
|
(13.28) |
Воспользуемся
формулой Стирлинга ![]() . Она справедлива при
количестве атомов
. Она справедлива при
количестве атомов![]() (а в данном случае
(а в данном случае ![]() число Авогадро). Тогда
число Авогадро). Тогда
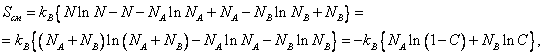
где ![]() .
.
В итоге получим
|
|
(13.29) |
Отметим, что ![]() , т. к. C и
, т. к. C и ![]() меньше единицы.
меньше единицы.
В
действительности чистые элементы A и B могут
состоять из изотопов, и их кристаллические решетки могут иметь вакантные узлы.
Ввиду этого статистические вероятности ![]() и
и ![]() имеют значения,
отличные от значений, даваемых формулами (13.25) и (13.27). Однако ошибки
оказываются одинаковыми для
имеют значения,
отличные от значений, даваемых формулами (13.25) и (13.27). Однако ошибки
оказываются одинаковыми для ![]() и
и ![]() и не изменяют
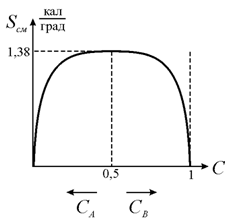
окончательной формулы для энтропии смешения. Зависимость энтропии смешения от
концентрации при количестве атомов, равном числу Авогадро, изображена на рис.
13.8. Кривая симметрична относительно вертикальной линии С = 0,5.
и не изменяют
окончательной формулы для энтропии смешения. Зависимость энтропии смешения от
концентрации при количестве атомов, равном числу Авогадро, изображена на рис.
13.8. Кривая симметрична относительно вертикальной линии С = 0,5.
|
|
|
Рис. 13.8. Зависимость энтропии смешения от концентрации |
Производная от энтропии смешения по концентрации
|
|
(13.30) |
стремится к бесконечности при C→0 и C→1. Это означает, что
в чистом веществе при незначительном загрязнении увеличение энтропии и,
следовательно, уменьшение термодинамического потенциала будет крайне велико.
Практически это означает, что затруднено получение чистых веществ, свободных от
примесей в малых концентрациях. Особенность зависимости энтропии смешения от
концентрации ![]() состоит в очень резком
росте энтропии
состоит в очень резком
росте энтропии ![]() при малых
концентрациях
при малых
концентрациях ![]() и
и ![]() , т. е. в резком уменьшении свободной энергии F=U-TS,
следовательно, при наличии смеси двух компонентов с малыми концентрациями
одного из них, энергетически более выгодно образование твердого раствора,
нежели смеси двух типов кристаллов чистых компонентов.
, т. е. в резком уменьшении свободной энергии F=U-TS,
следовательно, при наличии смеси двух компонентов с малыми концентрациями
одного из них, энергетически более выгодно образование твердого раствора,
нежели смеси двух типов кристаллов чистых компонентов.
Максимальное значение энтропии смешения для моля вещества
|
|
(13.31) |
где R −
универсальная газовая постоянная. Подставляя численные значения в соотношение
(13.31), получим ![]() (
(![]() − число Авогадро). Полученная величина максимальной
энтропии смешения сравнима со значениями энтропии твердых тел, т. е. энтропия
смешения составляет существенную долю энтропии твердого тела.
− число Авогадро). Полученная величина максимальной
энтропии смешения сравнима со значениями энтропии твердых тел, т. е. энтропия
смешения составляет существенную долю энтропии твердого тела.
Концентрационная зависимость
термодинамического потенциала твердого раствора
Энтропия неупорядоченного твердого раствора выражается формулой
|
|
(13.32) |
Она складывается из двух
составляющих: первый член – вибрационная часть энтропии, обусловленная
хаотичностью теплового движения атомов; второй – часть энтропии, связанная с
конфигурационной хаотичностью (энтропия смешения). Для компонентов с близкими
физико-химическими свойствами, что имеет место в твердых растворах,
теплоемкость твердого раствора при постоянном давлении![]() мало зависит от концентрации. Поэтому в выражении для
свободной энергии Гиббса можно разделить члены, зависящие от температуры, и
члены, зависящие от концентрации
мало зависит от концентрации. Поэтому в выражении для
свободной энергии Гиббса можно разделить члены, зависящие от температуры, и
члены, зависящие от концентрации
|
|
(13.33) |
Внутренняя энергия
твердого тела равна сумме энергий связи атомов и энергии теплового движения ![]() . Энергия теплового движения
. Энергия теплового движения ![]() , а энергия связи
, а энергия связи ![]() – это внутренняя
энергия тела при температуре 0 К. Для бинарного твердого раствора, состоящего
из атомов двух сортов A и B, энергия связи может быть
представлена в следующем виде:
– это внутренняя
энергия тела при температуре 0 К. Для бинарного твердого раствора, состоящего
из атомов двух сортов A и B, энергия связи может быть
представлена в следующем виде:
![]() ,
,
где ![]() ;
; ![]() ;
; ![]() – числа пар атомов сортов А и В,
Z – координационное число,
– числа пар атомов сортов А и В,
Z – координационное число, ![]() ,
, ![]() и
и ![]() − энергии связи
пар атомов сорта A с A, B с B и A с B
соответственно.
− энергии связи
пар атомов сорта A с A, B с B и A с B
соответственно.
Учитывая, что
числа атомов А и В в кристалле ![]() ;
; ![]() , где N – полное число атомов в кристалле,
С – концентрация атомов сорта В, и то, что у произвольно взятого атома
имеется
, где N – полное число атомов в кристалле,
С – концентрация атомов сорта В, и то, что у произвольно взятого атома
имеется ![]() соседей сорта A и ZС соседей сорта В, получим для энергии связи выражение
соседей сорта A и ZС соседей сорта В, получим для энергии связи выражение
|
|
(13.34) |
где![]() – энергия упорядочения, равная
– энергия упорядочения, равная
|
|
(13.35) |
Первые два члена в формуле (13.34) представляют собой энергию сплава, состоящего из смеси кристаллов чистых компонентов A и B при условии равенства координационных чисел Z в структурах компонентов. Эти члены дают линейную зависимость энергии от концентрации. Последний член уравнения (13.34), в который входит энергия упорядочения, обуславливает параболическую форму зависимости энергии от концентрации.
В
зависимости от знака энергии упорядочения ![]() возможны различные
виды концентрационной зависимости термодинамического потенциала от концентрации
G(С): при отрицательных
значениях энергии упорядочения
возможны различные
виды концентрационной зависимости термодинамического потенциала от концентрации
G(С): при отрицательных
значениях энергии упорядочения ![]() взаимодействие
атомов разного сорта сильнее, чем взаимодействие атомов одного сорта. В этом
случае зависимость имеет U-образную форму. Случай U-образной формы концентрационной зависимости
термодинамического потенциала благоприятствует образованию твердых растворов
или химических соединений.
взаимодействие
атомов разного сорта сильнее, чем взаимодействие атомов одного сорта. В этом
случае зависимость имеет U-образную форму. Случай U-образной формы концентрационной зависимости
термодинамического потенциала благоприятствует образованию твердых растворов
или химических соединений.
Рассмотрим систему с U-образной формой кривой G(С) (рис. 13.9). Используем для анализа молярный термодинамический потенциал
|
|
(13.36) |
где ![]() – число
молей i-го компонента.
– число
молей i-го компонента.
Кроме того, молярный потенциал можно выразить через
концентрации компонентов ![]() и значения химических
потенциалов
и значения химических
потенциалов ![]() :
:
|
|
(13.37) |
В случае, когда твердый раствор образуется двумя сортами атомов (бинарный твердый раствор), молярный потенциал
|
|
(13.38) |
![]() –
концентрация элемента B в твердом
растворе, тогда
–
концентрация элемента B в твердом
растворе, тогда ![]() .
.
|
|
|
Рис. 13.9. U-образная зависимость молярного термодинамического потенциала от концентрации [55] |
Касательная,
проведенная к кривой ![]() в точке с абсциссой
в точке с абсциссой ![]() , отсекает на оси ординат при
, отсекает на оси ординат при ![]() отрезок, равный
отрезок, равный ![]() , а при
, а при ![]() отрезок, равный
отрезок, равный ![]() . Здесь
. Здесь ![]() и
и ![]() – значения химических
потенциалов компонентов A и B в твердом
растворе концентрации
– значения химических
потенциалов компонентов A и B в твердом
растворе концентрации ![]() .
.
Согласно уравнению Гиббса–Дюгема,
|
|
(13.39) |
Для бинарного твердого раствора это уравнение принимает вид
|
|
(13.40) |
Продифференцируем уравнение (13.38) с учетом (13.40)
|
|
(13.41) |
решим систему уравнений (13.41), (13.38) относительно
значений химических потенциалов ![]() и
и ![]()
|
|
(13.42) |
Рассмотрим
приведенный выше рисунок. Отрезок 0L, отсекаемый касательной
к кривой зависимости молярного потенциала от концентрации ![]() в точке
в точке ![]() на оси ординат при
на оси ординат при ![]() , равен
, равен ![]() . Поскольку
. Поскольку ![]() ;
; ![]() , то
, то ![]() в силу (13.42).
в силу (13.42).
Аналогично можно
доказать, что отрезок, отсекаемый на другой оси при ![]() , равен
, равен ![]() .
.
Отсюда
вытекает, что при U-образной форме кривой ![]() система в равновесии
всегда однофазна. Действительно, при двухфазном равновесии фаз α и β с содержанием компонента B, равным
система в равновесии
всегда однофазна. Действительно, при двухфазном равновесии фаз α и β с содержанием компонента B, равным ![]() и
и ![]() , равенство химических потенциалов имеет вид:
, равенство химических потенциалов имеет вид:
![]() ;
; ![]() .
.
Графически это
означает, что касательные к кривой ![]() , построенные в точках
, построенные в точках ![]() и
и ![]() , должны отсекать на оси ординат при
, должны отсекать на оси ординат при ![]() и
и ![]() равные отрезки, т. е. касательные
должны совпадать, чего не может быть при кривой U-образной формы.
равные отрезки, т. е. касательные
должны совпадать, чего не может быть при кривой U-образной формы.
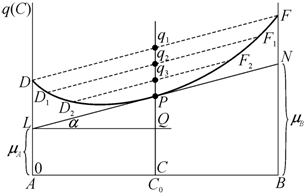
Таким образом,
система с U-образной формой кривой в
равновесии всегда однофазна. Однофазному состоянию отвечает минимум на кривой ![]() . Если бы система представляла собой гетерогенную смесь
чистых кристаллов, то термодинамический потенциал изменялся бы с концентрацией
линейно (пунктирные линии DF) и для сплава с
концентрацией
. Если бы система представляла собой гетерогенную смесь
чистых кристаллов, то термодинамический потенциал изменялся бы с концентрацией
линейно (пунктирные линии DF) и для сплава с
концентрацией ![]() определялся бы точкой
определялся бы точкой ![]() . Образование ограниченных твердых растворов понижает
значение молярного потенциала q (точки
. Образование ограниченных твердых растворов понижает
значение молярного потенциала q (точки ![]() ,
, ![]() ). Минимальному значению
). Минимальному значению ![]() соответствует точка P пересечения вертикальной линии
соответствует точка P пересечения вертикальной линии ![]() с кривой
с кривой ![]() твердого раствора. При
этом секущая прямая обращается в касательную. Следовательно, при U-образной форме
твердого раствора. При
этом секущая прямая обращается в касательную. Следовательно, при U-образной форме ![]() равновесному состоянию
отвечает непрерывный ряд твердых растворов.
равновесному состоянию
отвечает непрерывный ряд твердых растворов.
При положительных
значениях энергии упорядочения ![]() концентрационная
зависимость термодинамического потенциала имеет иную, чем в первом случае, W-образную форму [55]. Взаимодействие атомов одного сорта в
этом случае сильнее взаимодействия атомов разного сорта, поэтому
предпочтительнее образование гетерогенной смеси кристаллов чистых компонентов,
энергия связи которой меньше энергии связи твердого раствора.
концентрационная
зависимость термодинамического потенциала имеет иную, чем в первом случае, W-образную форму [55]. Взаимодействие атомов одного сорта в
этом случае сильнее взаимодействия атомов разного сорта, поэтому
предпочтительнее образование гетерогенной смеси кристаллов чистых компонентов,
энергия связи которой меньше энергии связи твердого раствора.
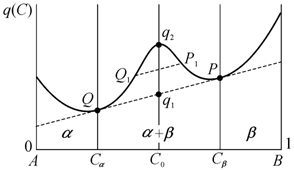
Рассмотрим
систему с W-образной формой кривой молярного
термодинамического потенциала в зависимости от концентрации ![]() (рис. 13.10).
(рис. 13.10).
|
|
|
Рис. 13.10. W-образная зависимость молярного термодинамического потенциала от концентрации [55] |
При W-образной форме концентрационной зависимости термодинамического
потенциала всегда существует пара точек P и Q, в
которых касательные к кривой ![]() совпадают. Наличие
общей касательной говорит о возможности двухфазного равновесия системы. Точки P и Q разбивают зависимость
совпадают. Наличие
общей касательной говорит о возможности двухфазного равновесия системы. Точки P и Q разбивают зависимость ![]() на три части. Для
сплавов с концентрацией элемента B, лежащей в интервале
на три части. Для
сплавов с концентрацией элемента B, лежащей в интервале ![]() или
или ![]() , равновесию отвечает однофазное состояние. Для сплавов с
концентрацией, лежащей в области промежуточного максимума
, равновесию отвечает однофазное состояние. Для сплавов с
концентрацией, лежащей в области промежуточного максимума ![]() , равновесное состояние двухфазно: система представляет собой
гетерогенную смесь кристаллов двух ограниченных твердых растворов α и β, концентрация которых
, равновесное состояние двухфазно: система представляет собой
гетерогенную смесь кристаллов двух ограниченных твердых растворов α и β, концентрация которых ![]() и
и ![]() определяется
абсциссами точек P и Q.
Концентрация твердых растворов α
и β не зависит от состава
сплава. Состав влияет только на весовое содержание фаз α и β в
гетерогенной смеси.
определяется
абсциссами точек P и Q.
Концентрация твердых растворов α
и β не зависит от состава
сплава. Состав влияет только на весовое содержание фаз α и β в
гетерогенной смеси.
В области промежуточного
максимума распад сплава на два ограниченных твердых раствора приводит к
понижению термодинамического потенциала: потенциал однофазного состояния
определяется точкой ![]() , а двухфазного – точкой
, а двухфазного – точкой ![]() . Следовательно, гетерогенное состояние сплава отвечает
равновесию, тогда как гомогенное – неравновесному состоянию.
. Следовательно, гетерогенное состояние сплава отвечает
равновесию, тогда как гомогенное – неравновесному состоянию.
Весовое
содержание![]() ,
, ![]() для α- и β-фаз в бинарного твердого раствора определяется правилом
рычага
для α- и β-фаз в бинарного твердого раствора определяется правилом
рычага
|
|
(13.43) |
Если отнормировать соотношение
(13.43) на единицу ![]() , то
, то
|
|
(13.44) |
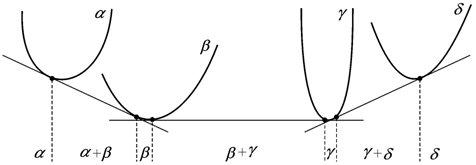
В бинарных системах, помимо твердых растворов на основе чистых компонентов, возможно образование промежуточных фаз. В этом случае на фазовых диаграммах появляются низколежащие ветви кривых термодинамического потенциала образующихся промежуточных фаз (рис. 13.11).
|
|
|
Рис. 13.11. Схематическая зависимость термодинамического потенциала от концентрации в бинарной системе в случае образования промежуточных фаз [55] |
Строя общие касательные к ветвям термодинамического потенциала, находят положение однофазных и двухфазных областей, и положение областей промежуточных фаз. Протяженность однофазных областей зависит от формы и взаимного расположения ветвей термодинамических потенциалов.
 .
.