13.2. Классификация фазовых
переходов
Пусть система определенного состава находится в состоянии термодинамического равновесия. При изменении температуры (T) или давления (p) равновесие в системе может нарушиться. Например, система, находящаяся в однофазном состоянии α, может перейти в другое равновесное однофазное состояние β. При этом происходит фазовое превращение, или фазовый переход [7, 55, 67].
Построим
схематически в пространстве p, T, μ
зависимость химических потенциалов ![]() и
и ![]() от температуры
и давления
от температуры
и давления![]() ,
, ![]() для двух
различных фаз (рис. 13.6).
для двух
различных фаз (рис. 13.6).
|
|
|
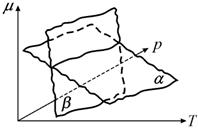
Рис. 13.6. Схематические зависимости химических потенциалов фаз α и β от давления и температуры |
Большей
устойчивостью обладает фаза с меньшим значением химического потенциала. Эта
фаза будет равновесной при определенных давлении и температуре. Кривая
пересечения поверхностей ![]() и
и ![]() представляет собой
линию фазового равновесия, отделяющую области существования этих фаз.
Изменением давления p и температуры T можно
перевести систему из одной области в другую, в результате при пересечении линии
фазового равновесия происходит фазовый переход.
представляет собой
линию фазового равновесия, отделяющую области существования этих фаз.
Изменением давления p и температуры T можно
перевести систему из одной области в другую, в результате при пересечении линии
фазового равновесия происходит фазовый переход.
Классификацию
фазовых переходов предложил Эренфест. Его основная идея состоит в разложении
выражения ![]() в ряд Тейлора по
степеням dT и dp (здесь
в ряд Тейлора по
степеням dT и dp (здесь ![]() ).
).
Фазовые переходы первого рода
Фазовые переходы
первого рода представляют собой переходы, при которых производные химических
потенциалов ![]() и
и ![]() по температуре
или по давлению не равны друг другу:
по температуре
или по давлению не равны друг другу:
|
|
(13.18) |
Результатом выполнения неравенств (13.18) являются скачкообразные изменения первых производных термодинамического потенциала Гиббса G по температуре и давлению в точке перехода. Поэтому в точке перехода скачкообразно изменяются и такие величины, как энтропия и объем
|
|
(13.19) |
Как следствие,
скачком изменяется и внутренняя энергия U, т. к.
термодинамический потенциал G одинаков для
находящихся в равновесии фаз и должен при переходе оставаться непрерывным. На
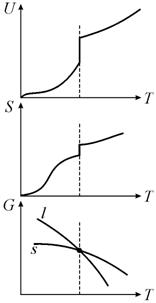
рис. 13.7 показана температурная зависимость внутренней энергии, энтропии и
энергии Гиббса для однокомпонентной термодинамической системы. На зависимости
потенциала Гиббса от температуры G(T) кривые,
обозначенные l и s, называются
соответственно линиями ликвидус и солидус. Выше линии ликвидус в
равновесии находится жидкая фаза, а ниже линии солидус − твердая. В точке
плавления (![]() ) наблюдается скачок внутренней энергии и энтропии, а термодинамический
потенциал Гиббса в ней непрерывен.
) наблюдается скачок внутренней энергии и энтропии, а термодинамический
потенциал Гиббса в ней непрерывен.
|
|
|
Рис. 13.7. Температурная зависимость внутренней энергии U, энтропии S и свободной энергии Гиббса G для однокомпонентной термодинамической системы |
Со скачкообразным изменением энтропии связана так называемая теплота перехода
|
|
(13.20) |
Переход I рода сопровождается выделением или поглощением теплоты перехода.
Примерами фазовых переходов I рода могут служить процессы, связанные с изменением агрегатного состояния вещества (плавление, испарение, сублимация, конденсация, кристаллизация); аллотропные превращения в твердом состоянии, упорядочение структуры, переход в сверхпроводящее состояние во внешнем магнитном поле.
Рассмотрим
фазовый переход первого рода на примере плавления кристаллического вещества.
Известно, что плавление чистого вещества протекает строго при определенной
температуре. При этом такие характеристики, как плотность, объем, изотермическая
сжимаемость, теплоемкость, электрическое сопротивление, изменяются
скачкообразно. При температуре плавления ![]() твердая и
жидкая фазы находятся в равновесии, которому соответствует точка пересечения
ветвей кривых ликвидус (l) и солидус (s) (рис. 13.6). Эти кривые
существуют по обе стороны от точки плавления, монотонно убывая с температурой.
Поскольку более устойчивой является фаза с меньшим значением термодинамического
потенциала, выше температуры плавления
твердая и
жидкая фазы находятся в равновесии, которому соответствует точка пересечения
ветвей кривых ликвидус (l) и солидус (s) (рис. 13.6). Эти кривые
существуют по обе стороны от точки плавления, монотонно убывая с температурой.
Поскольку более устойчивой является фаза с меньшим значением термодинамического
потенциала, выше температуры плавления ![]() жидкая фаза
будет равновесной, а твердая − метастабильной
(неустойчивой). Ниже температуры плавления
жидкая фаза
будет равновесной, а твердая − метастабильной
(неустойчивой). Ниже температуры плавления ![]() равновесна
твердая фаза, а жидкая − метастабильна. Метастабильным состояниям
соответствуют перегретый кристалл или переохлажденная жидкость, и такие
состояния наблюдаются экспериментально.
равновесна
твердая фаза, а жидкая − метастабильна. Метастабильным состояниям
соответствуют перегретый кристалл или переохлажденная жидкость, и такие
состояния наблюдаются экспериментально.
Таким образом,
изменение свойств каждой из фаз происходит плавно; скачкообразное изменение
свойств вещества в целом в точке плавления связано лишь с нарушением межфазной
стабильности. Отсюда, в частности, следует, что температура плавления вещества
обусловлена поведением обеих фаз и ее нельзя определить при рассмотрении только
одной из них, считая, например, что при ![]() кристаллическая
решетка разрушается вследствие слишком интенсивного движения составляющих ее
атомов. Кристаллическая решетка и выше температуры плавления все еще достаточно
устойчива (например, алюминий можно перегреть на 5 К выше температуры
плавления), но в обычных условиях кристаллическое состояние при температурах
выше температуры плавления не может находиться в равновесии с жидкой фазой.
кристаллическая
решетка разрушается вследствие слишком интенсивного движения составляющих ее
атомов. Кристаллическая решетка и выше температуры плавления все еще достаточно
устойчива (например, алюминий можно перегреть на 5 К выше температуры
плавления), но в обычных условиях кристаллическое состояние при температурах
выше температуры плавления не может находиться в равновесии с жидкой фазой.
Фазовые переходы второго рода
При фазовых
переходах второго рода химические потенциалы ![]() и
и ![]() двух фаз и их первые
производные по температуре или давлению соответственно равны друг другу, а
производные более высоких порядков различаются:
двух фаз и их первые
производные по температуре или давлению соответственно равны друг другу, а
производные более высоких порядков различаются:
|
|
(13.21) |
Следовательно, в точке фазового перехода II рода непрерывны не только термодинамический потенциал, но и его первые производные по температуре или давлению (энтропия и объем), тогда как вторые производные терпят разрыв (изменяются скачком).
Скачкообразно
изменяются и величины, выражающиеся через вторые производные: теплоемкость при
постоянном давлении ![]() , коэффициент объемного расширения
, коэффициент объемного расширения ![]() и сжимаемость
и сжимаемость ![]() :
:
|
|
(13.22) |
Эти величины могут претерпевать скачок и при фазовых переходах первого рода.
Поскольку при
фазовых переходах II рода энтропия меняется непрерывно, то отсутствует теплота
перехода (13.20). Особенность фазовых переходов II рода состоит в невозможности перегрева или переохлаждения
фаз: каждая фаза существует только в своем температурном интервале.
Высокотемпературное состояние в области ![]() (где
(где ![]() − температура
фазового перехода II
рода) теряет устойчивость и претерпевает превращение. То же можно сказать и о
низкотемпературной фазе в области
− температура
фазового перехода II
рода) теряет устойчивость и претерпевает превращение. То же можно сказать и о
низкотемпературной фазе в области ![]() .
.
Фазовые переходы II рода могут проходить по разным механизмам за счет:
• незначительного смещения атомов в решетке;
• изменения степени упорядоченности атомов в кристаллической фазе (переходы типа «порядок – беспорядок»);
• перехода вещества из ферромагнитного состояния в парамагнитное;
• перехода металлов из обычного в сверхпроводящее состояние.