Структура аморфных материалов и природа дефектов в них
VI. БЛИЖНИЙ ПОРЯДОК В АМОРФНЫХ ОКИСНЫХ ПЛЕНКАХ SiO2
Способность некоторых веществ существовать в нескольких кристаллических фазах, отличающихся друг от друга по симметрии структуры и по свойствам, называется полиморфизмом. Каждая из этих фаз - полиморфная модификация - стабильна в определенной области температур и давлений. Откликом системы на изменение внешних условий является фазовый переход - процесс превращения одной модификации в другую, - скорость протекания которого определяется целым рядом термодинамических и кинетических факторов: температурой, давлением и т.д.
Двуокись кремния обладает сложным полиморфизмом, который при нормальном давлении можно представить в виде следующей последовательности превращений, происходящих при нагревании:

На рис.24 показана фазовая диаграмма (диаграмма состояния) двуокиси кремния, отображающая в графической форме области температур и давлений, в которых существуют те или иные фазы SiO2, будучи термодинамически равновесными [57].
Диаграмма состояния двуокиси кремния.

Рис.24
Как следует из диаграммы состояния, β-тридимит и β -кристобалит исчезают при повышении давления быстрее, чем кварц, который переходит в коэзит при давлении 20000 - 40000 атм., в зависимости от температуры. В свою очередь, коэзит при давлениях 90000 - 100000 атм. переходит в стишовит. Необходимо отметить, что чем выше область давлений, в которой стабильна модификация, тем выше ее плотность.
Существует также ряд метастабильных фаз SiO2. Так например, можно получить переохлажденный кристобалит, который при температуре 270oC переходит из α-формы в α -форму. Аналогично
переохлажденный тридимит (γ) при 120oС переходит в α -фазу,
которая затем при 165oС превращается в β-фазу тридимита. Однако стабильным в указанной области температур является только кварц.
В таблице 7 приведены характеристики структуры и плотность полиморфных модификаций окисла кремния.
Таблица 7
Сингония, пространственная группа, периоды элементарной ячейки и плотность полиморфных фаз двуокиси кремния.
|
Модифика |
Сингония |
Простр. группа |
a, A |
b, A |
c, A |
Плотность, г/см3 |
|
α-кварц |
гексагон |
Р312 |
4,9500 |
4,9500 |
5,4300 |
2,649 |
|
β-кварц |
гексагон |
Р642 |
4,9990 |
4,9990 |
5,45700 |
2,534 |
|
β-трид. |
гексагон |
Р6/mmc |
5,0400 |
5,0400 |
8,2270 |
2,205 |
|
β-крист. |
кубич. |
Fd3m |
7,1340 |
7,1340 |
7,1340 |
2,198 |
|
Коэзит |
Монокл. |
|
7,2300 |
12,5200 |
7,2600 |
2,817 |
|
стишовит |
тетрагон. |
|
4,1800 |
4,1800 |
2,6600 |
4,294 |
|
α-тридим |
Ромбич. |
|
9,9000 |
17,1340 |
16,3330 |
2,160 |
|
α-крист. |
тетрагон. |
Р412 |
4,9731 |
4,9731 |
6,9260 |
2,330 |
|
Cтекло |
аморфное |
|
|
|
|
2,220 |
Прежде чем рассматривать характер полиморфных превращений в двуокиси кремния, отметим, что по Бюргеру полиморфные переходы классифицируются как реконструктивные и деформационные.
Реконструктивными называются переходы, при которых происходит общая реорганизация структуры, сопровождающаяся разрывом большого количества химических связей c последующим образованием новых связей. Реконструктивные переходы имеют высокую энергию активации и скорости протекания их малы. Симметрия и пространственные группы полиморфных модификаций, между которыми протекают реконструктивные переходы, существенно отличаются друг от друга, и поэтому зачастую реконструктивный фазовый переход не имеет места из-за кинетических затруднений. В таких случаях говорят, что фаза кинетически устойчива, хотя и термодинамически метастабильна [42].
Деформационные фазовые переходы происходят без разрыва химических связей, только путем их искажения. Процесс сопровождается лишь небольшим изменением кристаллической структуры, энергия активации такого процесса близка к нулю, то есть фазовое превращение протекает относительно легко. Резких различий в симметрии решетки также не наблюдается: фазы имеют родственные пространственные группы, но симметрия низкотемпературной модификации ниже.
В более подробной схеме классификации фазовых переходов Бюргер подразделяет как реконструктивные, так и деформационные превращения на две подгруппы: переходы, затрагивающие первую координационную сферу, и переходы, при которых сохраняется первая сфера, а изменения происходят во второй.
Кроме того, в отдельную группу выделяются переходы типа порядок - беспорядок. И наконец, любые из рассмотренных типов полиморфных превращений могут происходить как с изменением характера химической связи, так и без него.
Низкотемпературная модификация окисла SiO2 α-кварц при температурах выше 575оС переходит β-кварц. В обеих модификациях координационный многогранник - тетраэдр, в углах которого находятся атомы кислорода, а в центре атом кремния. Соседние тетраэдры связаны между собой углами. На рис.25 показана элементарная ячейка кварца и цепочка координационных многогранников в ней.
В таблице 8 приведен базис (совокупность координат трансляционно неэквивалентных атомов, принадлежащих данной элементарной ячейке) элементарных ячеек α и β-кварца [58,59].
Элементарная ячейка кварца и цепочка связанных углами кислородных тетраэдров, в центре которых находится Si.
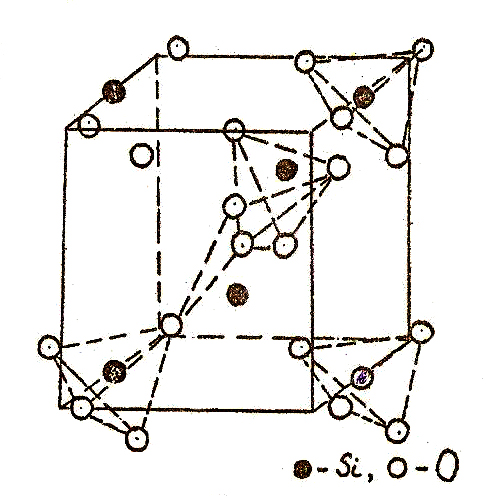
Таблица 8.
Базис элементарных ячеек α- и β-кварца.
|
Α-кварц |
β-кварц |
||||
|
X |
Y |
Z |
X |
Y |
Z |
|
координаты атомов кремния |
|||||
|
0,469 |
0 |
0 |
0,500 |
0 |
0 |
|
0,531 |
0,531 |
2/3 |
0,500 |
0,500 |
2/3 |
|
0 |
0,469 |
1/3 |
0 |
0,500 |
1/3 |
|
координаты атомов кислорода |
|||||
|
0,1463 |
0,7337 |
0,119 |
0,197 |
0,803 |
1/6 |
|
0,7337 |
0,1463 |
0,2143 |
0,803 |
0,197 |
1/6 |
|
0,2663 |
0,4126 |
0,4523 |
0,197 |
0,394 |
1/2 |
|
0,8537 |
0,5874 |
0,5476 |
0,803 |
0,606 |
1/2 |
|
0,4126 |
0,2663 |
0,881 |
0,384 |
0,197 |
5/6 |
|
0,5874 |
0,8537 |
0,7857 |
0,606 |
0,803 |
5/6 |
При переходе от α- b-кварцу атомы кремния сохраняют свои положения в слоях по Z: 0;1/3;2/3, а в направлениях осей Х,Y смещаются к центрам элементарных трансляций, причем это смещение невелико. Атомы кислорода в b-кварце располагаются в слоях, имеющих значения Z = 1/6; 1/2 и 5/6. В a-кварце эти слои "гофрированы": в направлениях X и Y смещения атомов кислорода больше, чем атомов кремния. Такие изменения координат свидетельствуют о том, что переход от β- к α-кварцу сопровождается поворотом тетраэдров, но при этом не происходит разрыва связей ни в первой, ни в последующих координационных сферах.
На рис.26 а, б расположение атомов в структурах α- и β-кварца представлено в проекции на плоскость XY. Видно, что структура тригонального α-кварца не содержит оси симметрии 6-го порядка, как это имеет место в β-кварце. Фазы имеют родственные пространственные группы, но симметрия в β-кварце выше. В обеих модификациях тетраэдры связаны углами и образуют шестичленные кольца. Угол связи между тетраэдрами составляет 145о. Переход α- => β-кварц - это яркий пример деформационного полиморфного превращения, поскольку в процессе его протекания происходит только снятие искажений и поворот тетраэдров, а связи Si-O не разрушаются (рис.26).
При 890 оС β-кварц переходит в β-тридимит. Координационный многогранник и гексагональный характер структуры сохраняются, и по-прежнему тетраэдры образуют шестичленные кольца (рис. 27), но структуру уже можно описать с помощью базоцентрированной, а не примитивной ячейки, и период ‘c’ возрастает примерно в полтора раза (табл.8, рис.28). Угол связи между тетраэдрами увеличивается до 180 градусов, причем связь является зеркально симметричной. В таблице 9 приведен базис элементарной ячейки β-тридимита. Из рис.25-28 видно, что если в α- и β-кварце атомы кислорода в тетраэдрах, образующих при взгляде на структуру сверху шестичленные кольца, не лежат в одной плоскости, то в β-тридимите одна из граней каждого из этих тетраэдров находится в плоскости, перпендикулярной оси Z. Противоположные ей вершины тетраэдров лежат выше и ниже плоскости рисунка на 1/4 с, чередуясь друг с другом. Следовательно, хотя координационный многогранник сохраняется при переходе от β-кварца к β-тридимиту, мотив распределения тетраэдров настолько различен, что фазовое превращение протекает с разрывом связей Si-O и образованием новых, и относится к классу реконструктивных.
Проекции структуры α- (a) и β-кварца (б) на плоскость XY
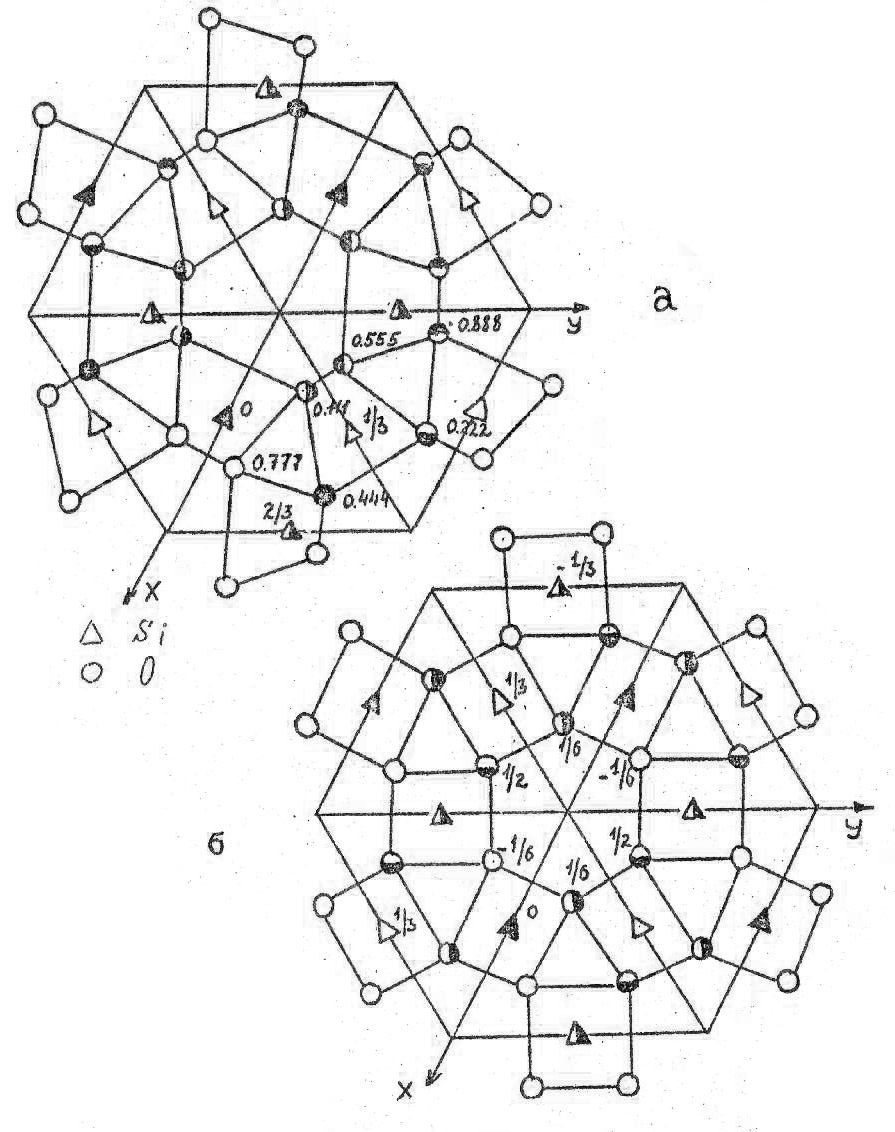
Проекция структуры β-тридимита на плоскость ХУ
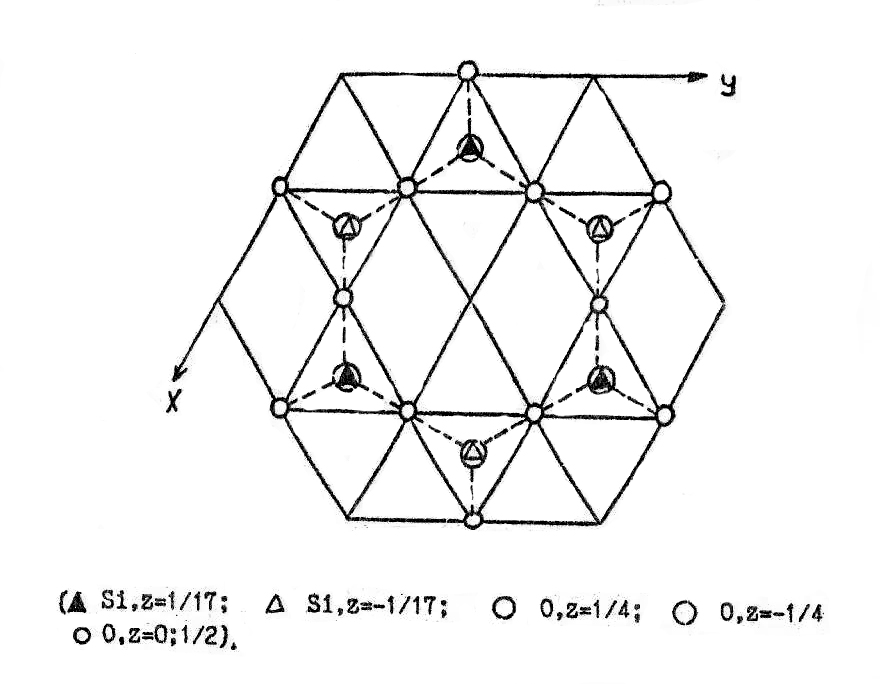
Таблица 9.
Базис элементарной ячейки β-тридимита.
|
X |
Y |
Z |
X |
Y |
Z |
|
координаты атомов кремния |
|||||
|
1/3 |
2/3 |
1/17 |
2/3 |
1/3 |
16/17 |
|
1/3 |
2/3 |
15/34 |
2/3 |
1/3 |
19/34 |
|
координаты атомов кислорода |
|||||
|
1/2 |
0 |
0 |
0 |
1/2 |
0 |
|
1/2 |
0 |
1/2 |
0 |
1/2 |
1/2 |
|
2/3 |
1/3 |
3/4 |
1/3 |
2/3 |
1/4 |
|
1/2 |
1/2 |
0 |
½ |
1/2 |
1/2 |
Элементарные ячейки β-кварца (а) и β-тридимита (б) и цепочки координационных многогранников в них
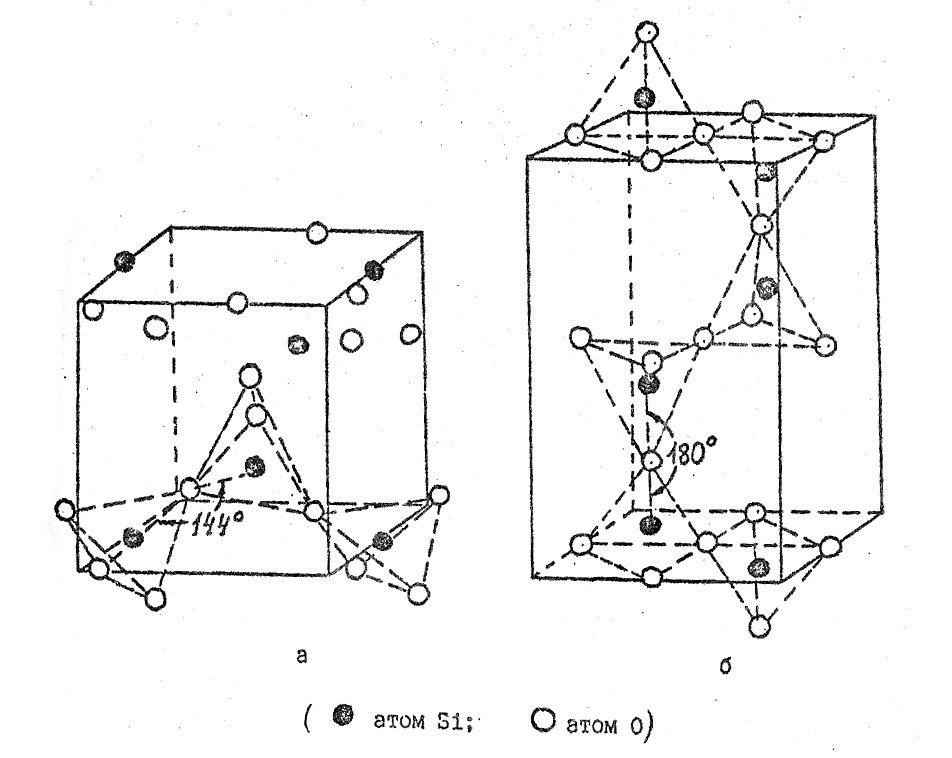
Переход β-тридимита в β-кристобалит происходит при температуре 1470оС. β-кристобалит представляет собой высокосимметричную модификацию двуокиси кремния, в которой атомы кремния образуют решетку типа алмаза, представляющую собой две вставленных друг в друга гранецентрированных кубических решетки, причем начало координат второй ячейки сдвинуто относительно начала координат первой на 1/4 диагонали куба. Атомы кислорода расположены на 1/2 расстояния между атомами кремния (рис.29).
Так же как в кварце и тридимите, первый координационный многогранник представляет собой тетраэдр из атомов кислорода, в центре которого находится атом кремния, а всю структуру можно представить себе в виде связанных углами тетраэдров. Угол связи между тетраэдрами составляет 180о, но атом кислорода находится в центре инверсии (рис.29).
Элементарная ячейка кристобалита
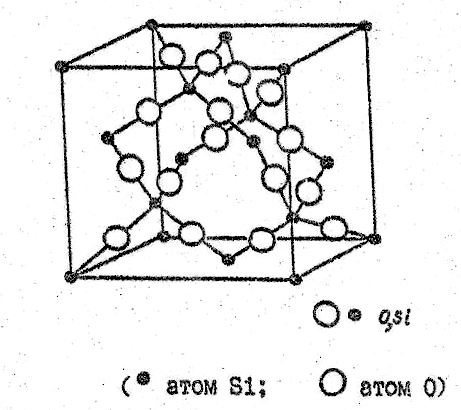
Рис.29
Для β-кристобалита известна также вторая модификация, хотя и тоже относящаяся к кубической сингонии, но имеющая более низкосимметричную пространственную группу Р213 (Т4) [59].
На рис. 30 приведены проекции расположения атомов в решетках обеих фаз β-кристобалита, на плоскость ХY, а в таблице 10 координаты Si и O для них. В кристобалите, кристаллическая структура которого характеризуется пространственной группой Р213, цепочки связанных углами тетраэдров изогнуты, а сами кислородные тетраэдры сильно искажены. Из рис.30 хорошо видно, что полиморфный переход между данными модификациями β-кристобалита носит деформационный характер, причем искажения решетки будут сниматься и за счет поворота тетраэдров, и за счет смещений образующих его атомов.
Таблица 10.
Базис элементарных ячеек неискаженной (Fd3m) и искаженной (Р213) полиморфных модификаций β-кристобалита
|
X |
Y |
Z |
X |
Y |
Z |
|
Пр. гр. Fs3m |
Пр.гр. Р213 |
||||
|
координаты атомов кремния |
|||||
|
0 |
0 |
0 |
0,992 |
0,992 |
0,992 |
|
0,5 |
0 |
0,5 |
0,508 |
0,008 |
0,492 |
|
0 |
0,5 |
0,5 |
0,008 |
0,492 |
0,508 |
|
0,5 |
0,5 |
0 |
0,492 |
0,508 |
0,008 |
|
0,25 |
0,25 |
0,25 |
0,250 |
0,250 |
0,250 |
|
0,75 |
0,25 |
0,75 |
0,750 |
0,250 |
0,750 |
|
0,25 |
0,75 |
0,75 |
0,250 |
0,750 |
0,750 |
|
0,75 |
0,75 |
0,25 |
0,750 |
0,750 |
0,250 |
|
координаты атомов кислорода |
|||||
|
0,125 |
0,125 |
0,125 |
0,125 |
0,125 |
0,125 |
|
0,375 |
0,375 |
0,125 |
0,440 |
0,340 |
0,160 |
|
0,875 |
0,875 |
0,125 |
0,840 |
0,940 |
0,160 |
|
0,625 |
0,625 |
0,125 |
0,660 |
0,660 |
0,060 |
|
0,125 |
0,375 |
0,375 |
0,160 |
0,440 |
0,375 |
|
0,625 |
0,875 |
0,375 |
0,560 |
0,840 |
0,340 |
|
0,375 |
0,125 |
0,375 |
0,340 |
0,160 |
0,440 |
|
0,875 |
0,625 |
0,375 |
0,875 |
0,625 |
0,375 |
|
0,125 |
0,625 |
0,625 |
0,060 |
0,660 |
0,660 |
|
0,625 |
0,125 |
0,625 |
0,660 |
0,060 |
0,660 |
|
0,375 |
0,875 |
0,625 |
0,375 |
0,875 |
0,625 |
|
0,875 |
0,375 |
0,625 |
0,840 |
0,340 |
0,560 |
|
0,125 |
0,875 |
0,875 |
0,160 |
0,840 |
0,940 |
|
0,625 |
0,375 |
0,875 |
0,625 |
0,375 |
0,875 |
|
0,375 |
0,625 |
0,875 |
0,340 |
0,560 |
0,840 |
|
0,875 |
0,125 |
0,875 |
0,940 |
0,160 |
0,840 |
Полиморфные переходы β-кварц => β-тридимит => β-кристобалит являются реконструктивными.
Проекции кристаллической структуры полиморфных фаз β-кристобалита на плоскость ХY.
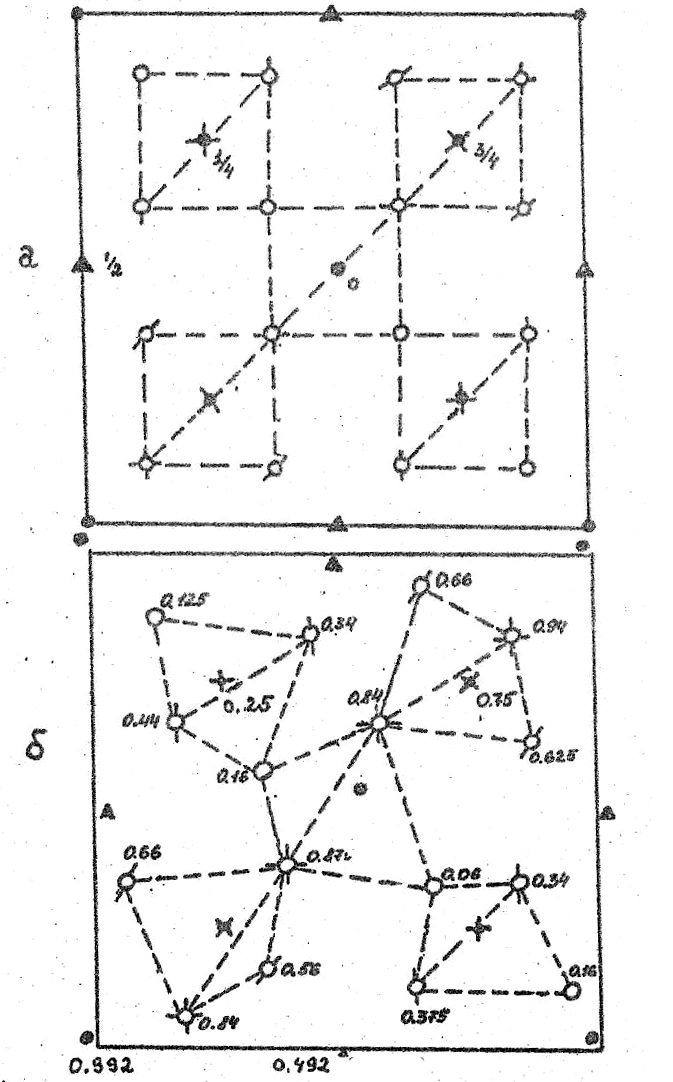
Указаны координаты z для всех атомов.
Знание координат атомов и размеров элементарных ячеек позволяет найти длины связей Si-O (rSi-O) в тетраэдрах, длины ребер тетраэдров (rO-O) и расстояния между центрами соседних тетраэдров (rSi-Si) для различных фаз двуокиси кремния. Результаты таких расчетов приведены и таблице 11.
Таблица 11.
Межатомные расстояния
в α-, β-кварце, β-тридимите и β-кристобалите
и угол связи Si-O-Si (φ).
|
Межатомные расстояния в ангстремах |
|||||
|
|
α- кварц |
β-кварц |
β-тридимит |
β-кристобалит |
|
|
|
|
Fd3m |
P213 |
||
|
rSi-O |
1.613-1627 |
1.612 |
1.533-1.573 |
1.550 |
1.550-1.664 |
|
rO-O |
2.624-2.665 |
2.494-2.737 |
2.520 |
2.530 |
2.450-2.742 |
|
rSi-Si |
3.077 |
3.091 |
3.067-3.146 |
3.100 |
3.069-3.200 |
|
φ |
142-145o |
147.5o |
180o |
180o |
156o |
Длина связи Si-O сокращается при переходе от α- к β-кварцу и далее к β-тридимиту и β-кристобалиту, имеющему пространственную группу симметрии Fd3m. Однако диапазон расстояний Si-O в искаженном β-кристобалите очень широк и максимальное значение величины rSi-O выше, чем во всех других рассматриваемых фазах двуокиси кремния. Средние значения расстояний между центрами соседних тетраэдров кратчайшие расстояния Si-Si - примерно одинаковы для всех представленных в таблице 10 фаз. Этот факт является следствием различия в углах связи φ в цепочке Si-O-Si: φ=2arcsin[rSi-Si/(2rSi-O)], результаты расчета которых приведены в таблице 11.
Кислородный тетраэдр в β-тридимите и β-кристобалите с пространственной группой Fd3m не искажен: длины всех ребер rO-Oодинаковы. В β-кварце и низкосимметричном β-кристобалите искажение тетраэдра больше, чем в α-кварце.
Аморфный диоксид кремния считается одной из полиморфных фаз SiO2, достаточно стабильной и в массивном, и в пленочном состоянии. Однако, как показали экспериментальные исследования аморфный - не означает одинаковый по атомному распределению: ближний порядок в нем зависит от способа приготовления.